Biacore Technologie
Der Gold-Standard in biomolekularer Interaktionsanalyse (BIA) mittels Oberflächen-Plasmonresonanz (SPR)
BIACORE SPR BIOSENSOREN
Ein Biacore System besteht aus einem Sensor-Chip, der mit einer biospezifischen Oberfläche versehen ist, einem optischen System für die Erzeugung und Detektion des SPR-Signals und einem integrierten Mikrofluss-System, dass den Transport der Proben über die Sensoroberfläche kontrolliert.
Einer der beiden zu untersuchenden Bindungspartner (Ligand) wird auf der Sensoroberfläche immobilisiert. Der andere Bindungspartner (Analyt) wird mit Hilfe des Mikrofluss-Systems über diese Oberfläche geleitet, wobei die Wechselwirkung direkt in Echtzeit mit Hilfe von Oberflächen Plasmon Resonanz verfolgt werden kann. Der große Vorteil dieser Methode ist, dass sie ganz ohne Markierungen der Biomoleküle auskommt. Abhängig von der Masse des Analyten nutzt Biaffin unterschiedliche Biacore Systeme, um höchste Sensitivität und die beste Leistung für das zu untersuchende Zielmolekül gewährleisten zu können.
SENSOR CHIP
Der Sensor-Chip besteht aus einer Glasscheibe, auf die eine dünne Goldschicht aufgebracht worden ist. Auf diese Goldoberfläche wurde eine biospezifische Oberfläche angebracht, die für die meisten Anwendungen aus carboxymethyliertem Dextran besteht. An diese hydrophile Matrix können Biomoleküle kovalent gekoppelt werden.
Immobilisierung
Kopplung des Liganden
Um eine Interaktionsanalyse durchführen zu können, muss zunächst einer der beiden Interaktionspartner auf der Oberfläche immobilisiert werden. Diesen nennt man den Liganden. Die Kopplung geschieht entweder durch eine kovalente (nicht-reversible) chemische Kopplung oder durch Fänger-Moleküle (Antikörper), die den Liganden mit hoher Affinität (reversibel) binden.
Bei der kovalenten Kopplung wird der Ligand über bestimmte funktionelle Gruppen an die Matrix aus carboxymethyliertem Dextran gekoppelt. Die am häufigsten eingesetzte Methode ist die Kopplung über eine primäre Aminogruppe, die z.B. in der Aminosäure Lysin vorhanden ist. Weitere funktionelle Gruppen, die sich gut für eine Kopplung eignen, sind Thiole (in Cystein) und Aldehyde.
Als Fänger-Moleküle werden meistens Antikörper eingesetzt, die hochspezifisch und mit hoher Affinität den Liganden binden. Voraussetzung für den Einsatz eines Antikörper als Fängermolekül sind eine langsame Dissoziationsgeschwindigkeit des Liganden und die vollständige Regenerierbarkeit ohne Verlust der Bindungsaktivität.
Immobilisierung eines antiGST Antikörpers über Aminkopplung
Beispiel für eine kovalente Immobilisierung eines Liganden über Aminkopplung auf einer Dextran Oberfläche. Die Oberfläche wird zunächst aktiviert, dann wird der Ligand unter optimierten Pufferbedingungen gekoppelt, und anschließend wird die Oberfläche deaktiviert. Die Differenz zwischen der Grundlinie und dem Signal nach der Deaktivierung entspricht der Menge an gekoppeltem Liganden.
Kovalente Kopplung über Cysteine
Oberflächen-Thiol-Methode
Die Oberflächen-Thiol-Kopplung nutzt Thiol-Gruppen auf der Sensoroberfläche aus und tauscht diese mit reaktiven Disulfidgruppen aus, die im Liganden durch Austausch von Carboxyl- oder Aminogruppen eingeführt worden sind. Diese Methode kann bei Liganden ohne eigene Thiolgruppen (z.B. keine Cysteine) angewandt werden und erlaubt so die Kopplung über andere funktionelle Gruppen des Liganden.
Liganden-Thiol-Methode
Die Liganden-Thiol-Kopplung nutzt eigene Thiol-Gruppen innhalb des Liganden (z.B. cysteine) zum Austausch mit reaktiven Disulfid-Gruppen an der Sensoroberfläche aus.
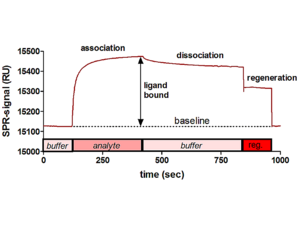
Detektionssystem
Während einer biomolekularen Interaktionsanalyse werden Assoziation und Dissoziation einer Wechselwirkung in Echtzeit analysiert. Das Bindungsereignis verursacht Änderungen des refaktiven Index an der Oberflächenschicht, die als Änderung des Oberflächen-Plasmonresonanz-Signals (SPR) detektiert werden. Diese Änderung im refraktiven Index ist proportional zur an der Oberfläche gebundenen Massenkonzentration und dabei unabhängig von der Art des gebundenen Biomoleküls (praktisch gleich für Proteine, Peptide und sehr ähnlich für Glycoproteine, Lipide und Nukleinsäuren). Dieser Wert wird als "Resonance Units" (RU) aufgezeichnet.
Während der Injektion des Analyten sieht man einen deutlichen Anstieg des SPR-Signals, was eine Bindung des Analyten an den auf der Biosensor-Oberfläche immobilisierten Liganden anzeigt. Aus der Kurvenform und der Konzentration des injizierten Analyten können sowohl Affinität als auch Assoziations- und Dissoziationsgeschwindigkeit berechnet werden. Um die Dissoziationsphase in Vorbereitung weiterer Messungen abzukürzen, wird eine Regenerationslösung injiziert, die den gebundenen Analyten wieder von der Oberfläche entfernt. Idealerweise erhält man eine vollständige Regeneration ohne Verlust der Bindungsaktivität des immobilisierten Liganden.
Wir schätzen Ihre Privatsphäre
Um unsere Webseite für Sie optimal zu gestalten und fortlaufend verbessern zu können, verwenden wir Cookies. Weitere Informationen erhalten Sie in unserer Datenschutzerklärung. Hier finden Sie unser Impressum.