Die cAMP-abhängige Proteinkinase als Modellsystem für Interaktionsstudien
Die cAMP-abhängige Proteinkinase ist ein Tetramer aus zwei monomeren katalytischen (C-) und zwei regulatorischen (R-) Untereinheiten. Die Aktivierung des inaktiven Holoenzyms geschieht durch Bindung von zyklischem AMP (cAMP) an die cAMP Bindestellen A und B in den regulatorischen Untereinheiten. Die Bindung von cAMP bewirkt eine Konformationsänderung, die eine Freisetzung und Aktivierung der katalytischen Untereinheiten zur Folge hat.
Der hitzestabile Proteinkinase Inhibitor PKI ist ein thermostabiler Pseudosubstratinhibitor und bindet an die katalytische Untereinheit der cAMP-abhängigen Proteinkinase. Durch die Wechselwirkung dieser beiden Proteine findet in der Zelle ein Export aus dem Zellkern statt, der die Transkriptionsaktivität beeinflusst.
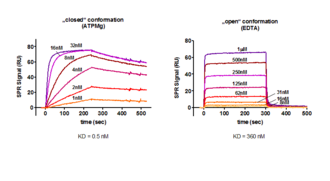
Abbildung: Interaktion zwischen dem hitzestabilen Proteinkinase Inhibitor PKI immobilisiert als Ligand auf einer Biacore Sensoroberfläche mit der katalytischen Untereinheit der cAMP-abhängigen Proteinkinase PKA-C(alpha). [Zimmermann et al., J. Biol. Chem. (1999), 274, 5370-5378]:
kass = 1.5 x106 M-1 s-1; kdiss = 7.6 x 10-4 s-1; KD = 0.5 nM
In Abwesenheit von ATP/Mg im Laufpuffer mit EDTA wechselt die PKA von ihrer geschlossenenen zur offenen Konformation, die eine völlig andere Bindungskinetik für PKI zeigt. Hier wird die Bindugsaffinität um den Fakter 720 auf KD = 360 nM reduziert.
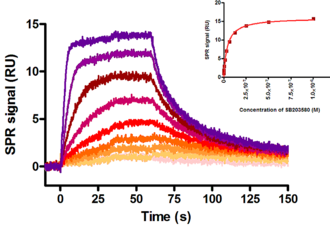
Abbildung: Interaktion zwischen der MAP Kinase p38 / SAPK2 alpha immobilisiert als Ligand auf einer Biacore S51 Sensoroberfläche mit dem spezifischen MAP Kinase Inhibitor SB203580 (Mw 377,4 Da).
kass = (1,9 ± 1,5) 106 M-1 s-1; kdiss = (5,1 ± 2,2) 10-2 s-1; KD = (32,1 ± 10,5) nM
Für weitere Informationen zu unseren Dienstleistungen im Bereich Proteinkinasen wenden Sie sich bitte an einen unserer Anwendungsspezialisten. Gerne erstellen wir Ihnen ein passendes Angebot für Ihre speziellen Anforderungen.
Wir schätzen Ihre Privatsphäre
Um unsere Webseite für Sie optimal zu gestalten und fortlaufend verbessern zu können, verwenden wir Cookies. Weitere Informationen erhalten Sie in unserer Datenschutzerklärung. Hier finden Sie unser Impressum.